52023年湖南省长沙市长郡中学高二上学期暑假作业检测化学

52023年湖南省长沙市长郡中学高二上学期暑假作业检测化学,目前趣答答案已经汇总了52023年湖南省长沙市长郡中学高二上学期暑假作业检测化学的各科答案和试卷,获取更多{{papers_name}}答案解析,请在关注本站。
本文从以下几个角度介绍。
-
1、长郡中学2024年高二寒假作业检测试卷化学
2、长郡中学2023-2024学年度高二第一学期期末考试化学
3、长郡中学2024高二期末考试化学
4、长郡中学2023-2024高二入学考试化学
5、湖南长郡2024高二化学考卷
6、2023-2024长郡中学高二期末考试化学
7、长郡中学2024高考模拟卷二化学
8、2023-2024长郡中学高三化学月考试卷
9、长郡中学2024至2024高一化学期末试卷
10、长郡中学2024高三月考一化学
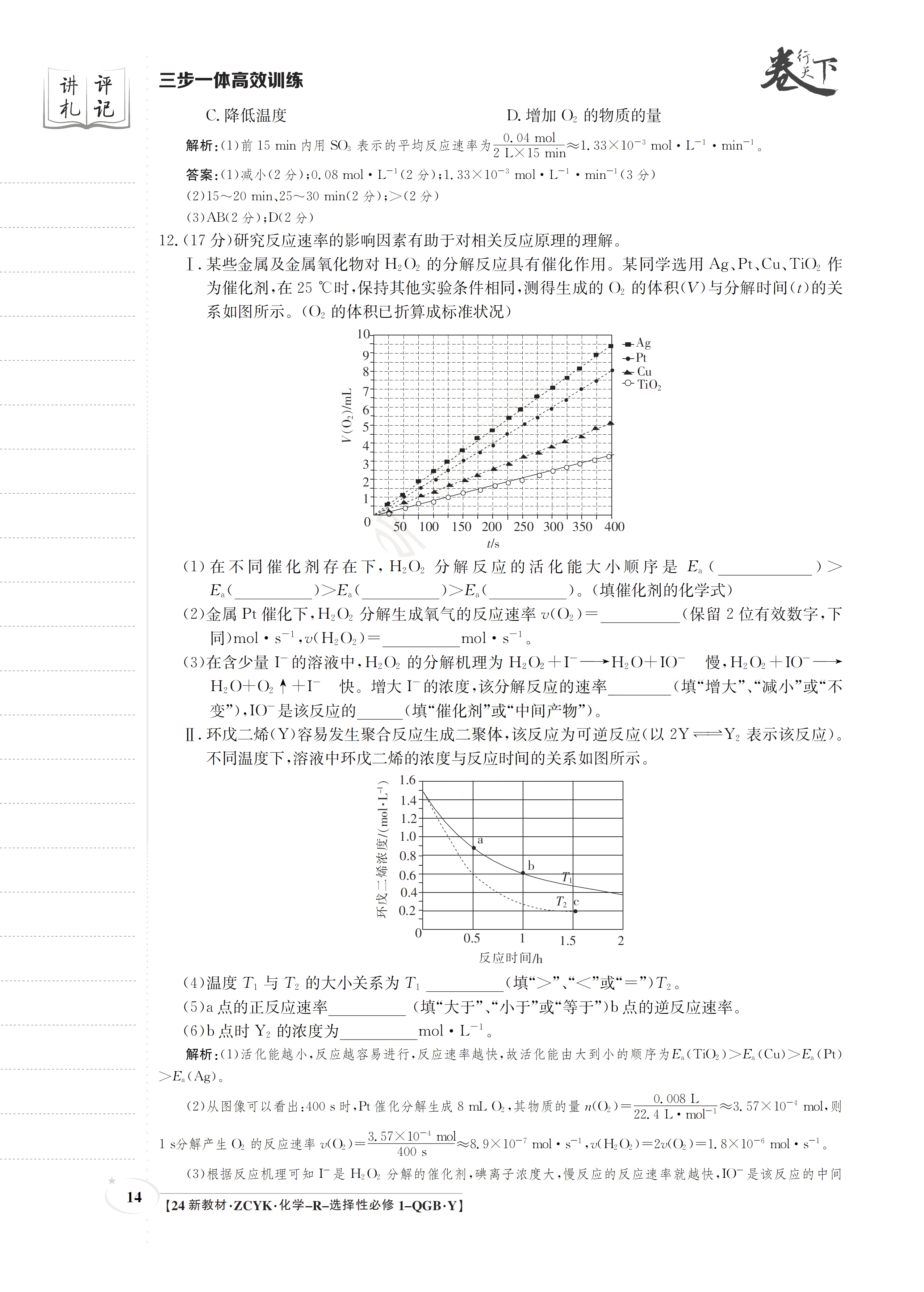 讲评三步一体高效训练记C.降低温度D.增加O2的物质的量解析:1)前15mn内用Ss0,表示的子均反应滤率为2是5n≈1.3X10nml.L·min。答案:(1)减小(2分):0.08mol·L-1(2分);1.33×10-3mol·L-1·min-1(3分)(2)15~20min、2530min(2分);>(2分)(3)AB(2分);D(2分)12.(17分)研究反应速率的影响因素有助于对相关反应原理的理解I.某些金属及金属氧化物对HO2的分解反应具有催化作用。某同学选用Ag、Pt、Cu、TO2作为催化剂,在25℃时,保持其他实验条件相同,测得生成的O2的体积(V)与分解时间(t)的关系如图所示。(O2的体积已折算成标准状况)10-Ag91-Pt在Cu-0Ti06◆5312050100150200250300350400t/s(1)在不同催化剂存在下,HO2分解反应的活化能大小顺序是E。(E()>E()>E()。(填催化剂的化学式)(2)金属Pt催化下,H2O2分解生成氧气的反应速率(O2)(保留2位有效数字,下同)mol·s-1,o(H2O2)=mol·s-1。(3)在含少量I厂的溶液中,H2O2的分解机理为H2O2+I厂→H2O十IO慢,H2O2十IO→HO十O2个十I厂快。增大I厂的浓度,该分解反应的速率(填“增大”、“减小”或“不变”),IO是该反应的(填“催化剂”或“中间产物”)。Ⅱ.环戊二烯(Y)容易发生聚合反应生成二聚体,该反应为可逆反应(以2Y一Y2表示该反应)。不同温度下,溶液中环戊二烯的浓度与反应时问的关系如图所示。1.61.41.21.00.80.60.40.2300.51.5反应时间h(4)温度T与T2的大小关系为T(填“>”、“<”或“=”)T2。(5)a点的正反应速率(填“大于”、“小于”或“等于”)b点的逆反应速率。(6)b点时Y2的浓度为mol·L1。解析:(I)活化能越小,反应越容易进行,反应速率越快,故活化能由大到小的顺序为Ea(TO2)>Ea(Cu)>E(Pt)>Ea(Ag)。0.0081(2)从图像可以看出:400s时,P催化分解生成8ml.0,其物质的量n0,)=22.4LmaF≈3.57X10mol.则1s分解产生0的反应速率0,)=357×10md8.9X10?ml·s,(H0)=2(0,)=1.8X105mal·s。400s(3)根据反应机理可知厂是HO2分解的催化剂,碘离子浓度大,慢反应的反应速率就越快,IO厂是该反应的中间14【24新教材.ZCYK.化学-R-选择性必修1-QGBY】
讲评三步一体高效训练记C.降低温度D.增加O2的物质的量解析:1)前15mn内用Ss0,表示的子均反应滤率为2是5n≈1.3X10nml.L·min。答案:(1)减小(2分):0.08mol·L-1(2分);1.33×10-3mol·L-1·min-1(3分)(2)15~20min、2530min(2分);>(2分)(3)AB(2分);D(2分)12.(17分)研究反应速率的影响因素有助于对相关反应原理的理解I.某些金属及金属氧化物对HO2的分解反应具有催化作用。某同学选用Ag、Pt、Cu、TO2作为催化剂,在25℃时,保持其他实验条件相同,测得生成的O2的体积(V)与分解时间(t)的关系如图所示。(O2的体积已折算成标准状况)10-Ag91-Pt在Cu-0Ti06◆5312050100150200250300350400t/s(1)在不同催化剂存在下,HO2分解反应的活化能大小顺序是E。(E()>E()>E()。(填催化剂的化学式)(2)金属Pt催化下,H2O2分解生成氧气的反应速率(O2)(保留2位有效数字,下同)mol·s-1,o(H2O2)=mol·s-1。(3)在含少量I厂的溶液中,H2O2的分解机理为H2O2+I厂→H2O十IO慢,H2O2十IO→HO十O2个十I厂快。增大I厂的浓度,该分解反应的速率(填“增大”、“减小”或“不变”),IO是该反应的(填“催化剂”或“中间产物”)。Ⅱ.环戊二烯(Y)容易发生聚合反应生成二聚体,该反应为可逆反应(以2Y一Y2表示该反应)。不同温度下,溶液中环戊二烯的浓度与反应时问的关系如图所示。1.61.41.21.00.80.60.40.2300.51.5反应时间h(4)温度T与T2的大小关系为T(填“>”、“<”或“=”)T2。(5)a点的正反应速率(填“大于”、“小于”或“等于”)b点的逆反应速率。(6)b点时Y2的浓度为mol·L1。解析:(I)活化能越小,反应越容易进行,反应速率越快,故活化能由大到小的顺序为Ea(TO2)>Ea(Cu)>E(Pt)>Ea(Ag)。0.0081(2)从图像可以看出:400s时,P催化分解生成8ml.0,其物质的量n0,)=22.4LmaF≈3.57X10mol.则1s分解产生0的反应速率0,)=357×10md8.9X10?ml·s,(H0)=2(0,)=1.8X105mal·s。400s(3)根据反应机理可知厂是HO2分解的催化剂,碘离子浓度大,慢反应的反应速率就越快,IO厂是该反应的中间14【24新教材.ZCYK.化学-R-选择性必修1-QGBY】
本文标签: